- Історія елемента
- Загальні властивості олова
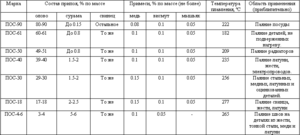
- Сплави на основі олова
- Використання елемента та його сполук
- Ефекти від впливу сполук олова
 Олово є м'який метал сріблясто-білого кольору. Воно настільки ковке і податливі, що його листи товщиною в тисячну частку міліметра можна згорнути в трубочку. Такий матеріал називається олов'яна папір. У періодичній таблиці елементів Д. І. Менделєєва цьому елементу відповідає номер 50, атомна вага 118, 69 і знак «Sn» (з лат. Станнум). Відомо 10 його стабільних ізотопів. Отримують метал в основному з мінералу касситерита, що представляє собою діоксид олова.
Олово є м'який метал сріблясто-білого кольору. Воно настільки ковке і податливі, що його листи товщиною в тисячну частку міліметра можна згорнути в трубочку. Такий матеріал називається олов'яна папір. У періодичній таблиці елементів Д. І. Менделєєва цьому елементу відповідає номер 50, атомна вага 118, 69 і знак «Sn» (з лат. Станнум). Відомо 10 його стабільних ізотопів. Отримують метал в основному з мінералу касситерита, що представляє собою діоксид олова.
В основному метал в сплаві зі свинцем використовується для пайки. Крім того, його використовують в якості антикорозійного покриття для харчових сталевих тар, оскільки воно є нетоксичним. Композити в складі з оловом використовуються в якості фунгіцидів, фарб, зубної пасти (SnF2) і кераміки.
Історія елемента
 Цей елемент був відкритий в 1854 році Халюсом Пелегріно. Однак його використання почалося задовго до цієї дати на Близькому Сході і Балканах близько 2000 років до нашої ери. В ту епоху була відкрита бронза (сплав олова і міді), яка дала назву Бронзовому Віку. Виробляли з бронзи зброю і знаряддя праці, які були ефективніші, ніж камінь і кістку.
Цей елемент був відкритий в 1854 році Халюсом Пелегріно. Однак його використання почалося задовго до цієї дати на Близькому Сході і Балканах близько 2000 років до нашої ери. В ту епоху була відкрита бронза (сплав олова і міді), яка дала назву Бронзовому Віку. Виробляли з бронзи зброю і знаряддя праці, які були ефективніші, ніж камінь і кістку.
В античні часи виробництво бронзи призвело до розвитку торгівлі між різними країнами. Також існують згадки про цей метал в Старому Завіті. Так, в Месопотамії робили бронзова зброя, а в Стародавньому Римі покривали оловом внутрішню поверхню мідних судин для підвищення їх корозійної стійкості.
Загальні властивості олова
Всі властивості цього металу можна розділити на дві великі групи: фізичні і хімічні.
Фізичні характеристики
 Це сріблястий ковкий метал, який легко окислюється при температурі навколишнього середовища, при цьому колір олова змінюється на темно-сірий. Якщо зігнути пластину з цього металу, то можна почути характерний звук, так званий «крик олова», який виникає через тертя між складовими його кристалами. Однією з яскраво виражених його характеристик є різке погіршення механічних властивостей при певних умовах, що носить назву «олов'яна чума»: нижче температури -18 ° C відбувається руйнування металу, і він починає виглядати, як сірий порошок.
Це сріблястий ковкий метал, який легко окислюється при температурі навколишнього середовища, при цьому колір олова змінюється на темно-сірий. Якщо зігнути пластину з цього металу, то можна почути характерний звук, так званий «крик олова», який виникає через тертя між складовими його кристалами. Однією з яскраво виражених його характеристик є різке погіршення механічних властивостей при певних умовах, що носить назву «олов'яна чума»: нижче температури -18 ° C відбувається руйнування металу, і він починає виглядати, як сірий порошок.
Чисте олово має дві аллотропних модифікації: сіру і білу. Сіра модифікація має кубічну кристалічну структуру, є напівпровідником, дуже тендітна, має низьку щільність і стабільна при температурі нижче 13, 2 ° C. Біла аллотропная модифікація має тетрагональную кристалічну структуру, добре проводить електричний струм і стабільна при температурах вище 13, 2 ° C.
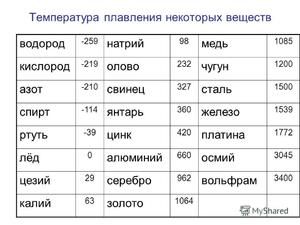
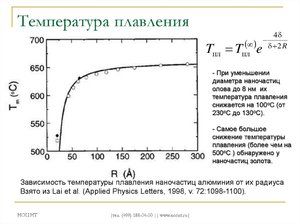
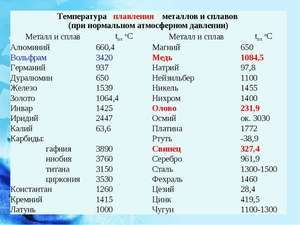
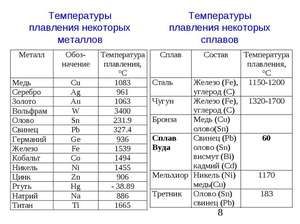
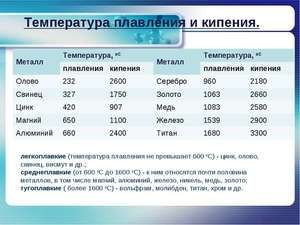
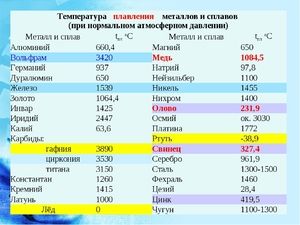
Плавиться метал при відносно низькій температурі 232 ° C (для порівняння: залізо плавиться при тисяча п'ятсот тридцять п'ять ° C). При цьому необхідно розуміти, відповідаючи на питання, при якій температурі плавиться олово, що плавиться саме його біла аллотропная модифікація. Незважаючи на низьку температуру плавлення, кипіння металу відбувається при відносно високій температурі 2602 ° C (залізо кипить при 2750 ° C).
Хімічні властивості
 Найбільш важливим мінералом є каситерит, SnO2. Однак, в даний час невідомі рудні родовища з високим відсотковим вмістом цього мінералу. Більшу частину касситерита в світі добувають з наносних покладів низької якості. Саме з цього мінералу отримують олово в промислових масштабах. Для цього касситерит подрібнюють, отримуючи його концентрат, а потім він піддається плавці разом з коксом, кварцом і вапном в доменній печі. Після цього виливки у вигляді блоків проходять остаточне очищення від домішок вісмуту, міді і заліза.
Найбільш важливим мінералом є каситерит, SnO2. Однак, в даний час невідомі рудні родовища з високим відсотковим вмістом цього мінералу. Більшу частину касситерита в світі добувають з наносних покладів низької якості. Саме з цього мінералу отримують олово в промислових масштабах. Для цього касситерит подрібнюють, отримуючи його концентрат, а потім він піддається плавці разом з коксом, кварцом і вапном в доменній печі. Після цього виливки у вигляді блоків проходять остаточне очищення від домішок вісмуту, міді і заліза.
Хімічний елемент олово добре реагує як з сильними кислотами, так і з сильними підставами, проте щодо інертний в нейтральних розчинах. Піддається корозії в присутності окисних середовищ, в відсутності кисню метал практично не піддається корозії. При окисленні на поверхні металу утворюється щільна оксидна плівка, яка захищає решту його частина від подальшого окислення.
 Якщо при розчиненні солей у воді утворюється кисле середовище, тоді в присутності окислювачів або повітря олово вступає в реакцію. До таких солей належать хлориди, наприклад, алюмінію і заліза. Більшість наведених рідин, наприклад, масла і спирти практично не вступають в реакцію з оловом. Саме олово і його прості неорганічні солі не є токсичними, проте, деякі органічні композити володіють токсичністю.
Якщо при розчиненні солей у воді утворюється кисле середовище, тоді в присутності окислювачів або повітря олово вступає в реакцію. До таких солей належать хлориди, наприклад, алюмінію і заліза. Більшість наведених рідин, наприклад, масла і спирти практично не вступають в реакцію з оловом. Саме олово і його прості неорганічні солі не є токсичними, проте, деякі органічні композити володіють токсичністю.
Оксид олова (II), SnO є кристалом чорно-синього кольору, який розчиняється в кислотах і підставах. Його використовують для виробництва солей в гальванопластике і при виробництві скла. Оксид олова (IV), SnO2 являє собою білу пил, нерозчинну в кислотах. Його використовують в якості незамінного компонента для забарвлення в рожевих, жовтих і коричневих кераміках, а також в діелектриках і тугоплавких сплавів. Він є важливим агентом під час полірування мармуру та інших декоративних каменів.
Хлорид олова (II), SnCl2 є основним інгредієнтом в олов'яної кислоти для пайки. Хлорид олова (IV), SnCl4 використовується в якості хімічного інгредієнта для додання ваги шовкової тканини, а також для стабілізації деяких парфумерних продуктів і стабілізації кольору мила, а SnF2, що має білий колір і розчинний у воді, застосовується в якості добавки до зубних паст.
Органічні хімічні сполуки на основі цього елемента - це такі сполуки, в яких присутній хоча б один зв'язок олова з воднем, Sn-H, і в яких метал проявляє ступінь окислення +4. Органічні сполуки, які знайшли своє застосування в індустрії, мають такі хімічними формулами:
- R4Sn;
- R3SnX;
- R2SnX2;
- RSnX3.
Тут R - органічна група, наприклад, метил, етил, бутил і інші, а X - неорганічний елемент, наприклад, хлор, кисень, флор і інші.
Сплави на основі олова
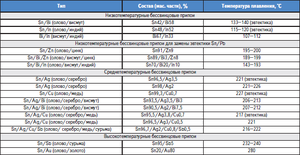 Сплави на основі олова також відомі, як білі метали, зазвичай містять в своєму складі мідь, сурму і свинець. Сплави мають різними механічними властивостями в залежності від їх складу.
Сплави на основі олова також відомі, як білі метали, зазвичай містять в своєму складі мідь, сурму і свинець. Сплави мають різними механічними властивостями в залежності від їх складу.
Сплави олова зі свинцем знайшли своє комерційне використання для широкого набору складів. Так, 61, 9% олова і 38, 1% свинцю відповідають евтектичних складу, градус затвердіння якого становить 183 ° C. Сплави з іншим співвідношенням цих металів плавляться і кристалізуються в широкому інтервалі температур, коли існує рівновага між твердою і рідкою фазами. При такій кристалізації в розплаві починають виділятися тверді сегрегації, які призводять до утворення різних структур. Сплав евтектичного складу, так як має найменшу температуру плавлення, використовується в якості запобіжника від перегріву компонентів електроніки.
Також існують сплави, в яких крім зазначених металів присутня невелика кількість сурми (до 2, 5%). Основною проблемою сплавів на основі олова і свинцю є їх негативний вплив на екологію, тому останнім часом розробляються їх замінники, в яких не використовується свинець, наприклад, сплави з сріблом і міддю.
Сплави олова зі свинцем і сурмою використовують для декоративних прикрас, а деякі сплави олова, міді і сурми використовують як мастило для зменшення тертя в підшипниках, завдяки їх антифрикційним властивостям. Крім вищесказаних сплавів, олово використовують в бронзових сплавах і в сплавах з титаном і цирконієм.
Використання елемента та його сполук
Всі сфери людського виробництва, в яких прямо або побічно використовується цей елемент, перераховані нижче:
 Захист від корозії і механічного впливу сталей і інших металів, наприклад, при виробництві консервних банок;
Захист від корозії і механічного впливу сталей і інших металів, наприклад, при виробництві консервних банок;- Зменшення крихкості скла, а також при виробництві дзеркал;
- У карбованих візерунках на різної посуді;
- Використання в фунгіцидах, фарбах, зубних пастах і різних пігментах.
- При отриманні різних сплавів, наприклад, бронз.
- Для низькотемпературної пайки або пайки з м'яким припоєм;
- У складі зі свинцем при виробництві металевих листів для музичних інструментів;
- При виробництві етикеток різної продукції;
- У сплавах, які оберігають від перегріву електричні апарати і електронні мікросхеми;
- У керамічної індустрії для виробництва емалей як матуючого агента.
- В капсулах для закупорювання пляшок з вином. Виробництво таких капсул розширилося після заборони використання свинцю в харчовій промисловості.
Ефекти від впливу сполук олова
Активність сполук з цим елементом, так чи інакше, впливає, як на організм людини, так і на екологію.
На здоров'я людини
 Як уже згадувалося, найбільш небезпечними для здоров'я людини є органічні хімічні сполуки олова. Ці речовини широко використовуються в індустрії, наприклад, при виробництві фарб, пластику і пестицидів для агрокультури. Крім того, обсяги виробництва органічних сполук з цим металом постійно зростають незважаючи на те, що відомі наслідки отруєння ними.
Як уже згадувалося, найбільш небезпечними для здоров'я людини є органічні хімічні сполуки олова. Ці речовини широко використовуються в індустрії, наприклад, при виробництві фарб, пластику і пестицидів для агрокультури. Крім того, обсяги виробництва органічних сполук з цим металом постійно зростають незважаючи на те, що відомі наслідки отруєння ними.
Ефекти від впливу цих речовин на людину різноманітні, все залежить від типу з'єднання і від індивідуальних особливостей організму. Небезпека з'єднання корелює з довжиною зв'язку між металом і воднем, чим довше цей зв'язок, тим менш небезпечно з'єднання. У зв'язку з цим, найнебезпечнішим органічною речовиною вважається з'єднання олова з трьома етиловим групами, водневі зв'язки якого є відносно короткими.
Потрапити в організм людини ці речовини можуть через їжу, повітряно-крапельним шляхом або від простого дотику до них. Відомі такі ефекти впливу органічних сполук олова на організм людини:
- При знаходженні в приміщенні, що містить пари цього металу, сильне подразнення верхніх дихальних шляхів, шкірних покривів і очей;
- Головні болі, болі в шлунку і відсутність апетиту;
- Нудота і блювання;
- Проблеми при сечовипусканні;
- Сильне потовиділення і задишка.
Перераховані ефекти можуть призвести до більш серйозних наслідків:
- депресія;
- Проблеми з печінкою;
- Порушення роботи імунної системи;
- Пошкодження хромосом клітин і недолік червоних тілець в крові;
- Пошкодження мозку (порушення сну, головні болі, провали пам'яті, роздратований стан).
На навколишнє середовище
 Як атоми олова, так і сам метал в чистому стані не є токсичними ні для одного організму на землі, в свою чергу, практично всі з'єднання з цим елементом органічного характеру є шкідливими. Ці сполуки можуть перебувати в навколишньому середовищі протягом тривалого періоду часу. Вони є досить стійкими і практично не розкладаються під впливом мікроорганізмів, завдяки своїм міцним водневим зв'язкам. Наскільки б малі не були концентрації сполук цього металу в грунті і воді, з огляду на сказаного вище, вони постійно зростають.
Як атоми олова, так і сам метал в чистому стані не є токсичними ні для одного організму на землі, в свою чергу, практично всі з'єднання з цим елементом органічного характеру є шкідливими. Ці сполуки можуть перебувати в навколишньому середовищі протягом тривалого періоду часу. Вони є досить стійкими і практично не розкладаються під впливом мікроорганізмів, завдяки своїм міцним водневим зв'язкам. Наскільки б малі не були концентрації сполук цього металу в грунті і воді, з огляду на сказаного вище, вони постійно зростають.
Відомо, що органічні олов'яні з'єднання завдають великої шкоди водним екосистемам, оскільки вони є отруйними для грибів, водоростей і фітопланктону. Фітопланктон же є важливою ланкою водної екосистеми, оскільки він виробляє кисень для всіх інших живих організмів цієї системи, а також є важливою частиною в харчовому ланцюгу. Токсичність сполук олова різна для різних живих істот, наприклад, трібутіловое олово є отруйним для риб і грибів, в той час як самим токсичною сполукою для фітопланктону є тріфеноловое олово.
Також відомо, що органічні сполуки цього елемента роблять негативний вплив на зростання і репродуктивну функцію тварин, порушують роботу ферментів. Такі сполуки накопичуються головним чином у верхніх шарах грунту і води.